مقدمهای بر خوردگی
پدیده خوردگی طبق تعریف، واکنش شیمیایی یا الکتروشیمیایی بین یک ماده، معمولا یک فلز، و محیط اطراف آن میباشد که به تغییر خواص ماده منجر خواهد شد. پدیده خوردگی در تمامی دستههای اصلی مواد، شامل فلزات، سرامیکها، پلیمرها و کامپوزیتها اتفاق می افتد، اما وقوع آن در فلزات آنقدر شایع و فراگیر بوده و اثرات مخربی بجای میگذارد که هرگاه صحبت از خوردگی به میان می آید، ناخودآگاه خوردگی یک فلز به ذهن متبادر میشود.
خوردگی معمولا فرایندی زیانآور است، لیکن گاهی اوقات مفید واقع میشود. بطور مثال آلودگی محیط به محصولات خوردگی و آسیب دیدن عملکرد یک سیستم از جنبههای زیان آور خوردگی و تولید انرژی الکتریکی در یک باطری و حفاظت کاتدی سازههای مختلف از فواید آن هستند، اما تاثیرات مخرب و هزینههای به بار آمده بواسطه این فرایند به مراتب بیشتر است.
با نگاهی به آمار منتشر شده از خسارات مستقیم و غیر مستقیم خوردگی به اقتصاد کشورها میتوان به هزینههای سرسامآور این پدیده پی برد. یک مطالعه دو ساله از ۱۹۹۹تا ۲۰۰۰ در آمریکا نشان داد که هزینههای مستقیم خوردگی ۲۷۶ میلیارد دلار در سال بوده است که این رقم تقریبا ۳.۱% از تولید ناخالص داخلی آمریکا را تشکیل می دهد. از این رقم هزینهای بالغ بر ۱۳۷.۹ میلیارد دلار به بخش صنعت که خود دارای زیرشاخههای مختلفی است مربوط میباشد.
در ایران نیز پدیده خوردگی خسارات قابل توجهی را در صنایع گوناگون بوجود آورده است. بر اساس برخی بررسیهای غیر رسمی، زیان اقتصادی مستقیم ناشی از خوردگی در ایران در سال ۱۳۷۳ حدود ۵۰۰۰ میلیارد ریال، در سال ۱۳۷۵ حدود ۹۰۰۰ میلیارد ریال و در سال ۱۳۷۹حدود ۲۷۵۰۰ میلیارد ریال برآورد شده است.
جایگاه آکادمیک
هر چند دانش مهندسی خوردگی در برخی از دانشگاههای دنیا از زیر شاخه های علم و مهندسی شیمی بوده و ارتباط تنگاتنگی نیز با آن دارد، در کشور ما سیاستگذاری در وزارت علوم، تحقیقات و فناوری بگونهای بوده است که مهندسی خوردگی، از زیرشاخههای مهندسی مواد قرار داده شده است.
علم و مهندسی مواد که به شناخت ویژگیهای فیزیکی و مکانیکی مواد مختلف، روشهای ساخت آنها، روشهای استحصال فلزات و مواد نوین میپردازد، به لحاظ ساختار آکادمیک در کشور ما در مقطع کارشناسی دارای سه زیر شاخه مهندسی متالورژی صنعتی، مهندسی متالورژی استخراجی و مهندسی سرامیک است.
در مقطع کارشناسی ارشد، مهندسی مواد به زیرشاخههای انتخاب مواد مهندسی، شکل دهی فلزات، خوردگی، استخراج فلزات، سرامیک، بیومواد، ریخته گری و جوشکاری طبقه بندی شده است. با این توضیح مشخص است که برای تحصیل در رشته مهندسی خوردگی لازم است تا از مقطع کارشناسی در رشته مهندسی مواد آغاز کرد.
دانش خوردگی مواد، بویژه فلزات همه صنایع را تحت تاثیر خود قرار داده و مهندسین این رشته همواره در تلاش هستند تا روشهای موجود برای مقابله با اثرات زیانبار این پدیده را بهبود بخشیده و یا روشهای نوینی برای این کار بیابند. از آنجا که گستره نفوذ خوردگی در صنایع بسیار وسیع است، بنظر میرسد آشنایی با اصول و مبانی فرایند خوردگی و همچنین روشهای عمومی برای کنترل این پدیده برای همه مهندسین ضروری است.
تعریف خوردگی
خوردگی یک واکنش شیمیایی و یا الکتروشیمیایی مخرب بین سطح فلز و محیط اطراف آن میباشد. با توجه به اینکه از لحاظ ترمودینامیکی مواد اکسید شده نسبت به مواد در حالت معمولی در سطح پایینتری از انرژی قرار دارند، بنابراین تمایل رسیدن به سطح انرژی پایینتر سبب اکسید (خورده) شدن فلز میگردد. با این توضیح میتوان گفت که هیچگاه نمیتوان به طور کامل از خوردگی جلوگیری نمود، بلکه باید به نحوی میزان خوردگی را به حد قابل قبول رسانید.
خوردگی سبب به وجود آمدن زیانهای فراوانی در کارایی سیستمهای مختلف میگردد. علاوه بر خسارتهای جانی از نظر اقتصادی نیز خسارتهای فراوانی ایجاد مینماید. به طور کلی برای بررسی یک آلیاژ از نظر مقاومت در برابر خوردگی باید پارامترهای گوناگونی را مورد بررسی قرار داد، اما شاید متداولترین راه برای بررسی مسائل خوردگی و همچنین مقایسه فلزات مختلف با یکدیگر، بیان نمودن سرعت و یا نرخ انجام واکنش خوردگی باشد. برای انجام این کار راهها و مقیاسهای متفاوتی وجود دارد.
برای بیان سرعت خوردگی میتوان درصد کاهش وزن را بر حسب میلیگرم بر سانتیمتر مربع بر روز (mdd) بیان نمود. البته این معیار چندان مناسب نمیباشد، زیرا در اکثر موارد محصولات حاصل از واکنش خوردگی (اکسید و یا هیدروکسید فلز) بر روی سطح فلز میمانند و در حقیقت سبب افزایش وزن فلز بعد از انجام واکنش خوردگی میگردند. بنابراین معمولاً به دلیل اهمیت بیشتر ضخامت قطعه، از معیار هزارم اینچ در سال(mpy) استفاده میگردد، یعنی در طول یک سال چه میزان از ضخامت جسم کاسته میشود.
خوردگی را میتوان از نظر الکتروشیمیایی نیز مورد بررسی قرار داد. به طور کلی هر واکنشی را که بتوان به دو واکنش جداگانه آندی و کاتدی قسمت نمود، واکنش الکتروشیمیایی مینامند. برای انجام واکنش خوردگی سه عامل آند (قسمتی که الکترون تولید مینماید و یا به عبارت دیگر اکسید میگردد)، کاتد (قسمتی از فلز که الکترون میگیرد و یا واکنش احیا در آن صورت میگیرد) و در نهایت الکترولیت (مکانی برای برقراری اتصال یونی بین آند و کاتد) لازم میباشد. در حقیقت باید بین آند و کاتد هم اتصال الکتریکی (برای مبادله الکترون) و هم اتصال الکترولیتی (برای مبادله یون) برقرار باشد. با از بین بردن هر کدام از این اتصالات واکنش خوردگی نیز متوقف میگردد.
به عنوان مثال در واکنش خورده شدن روی در محیط اسیدکلریدریک محصول نهایی واکنش کلرور روی و گاز هیدروژن میباشد که از طریق واکنش زیر انجام میگردد:
Zn + ۲ HCl →ZnCl۲ + H۲
به طور خلاصه میتوان واکنشهای اکسیداسیون و احیا را برای این واکنش به صورت زیر بیان نمود:
Zn → Zn+۲ + ۲e-
۲H+ + ۲e- → H۲
در شکل زیر نمایی از چگونگی انجام واکنش خوردگی فلز روی در محلول اسید کلریدریک حاوی اکسیژن نشان داده شدهاست.
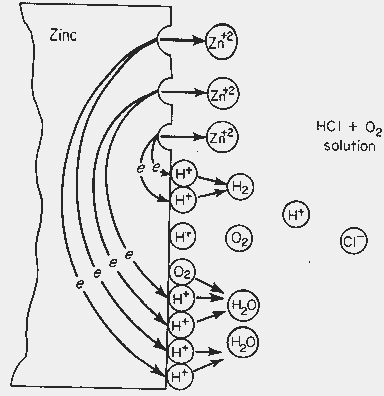
نمایی از چگونگی انجام واکنش خوردگی فلز روی در محیط اسید کلریدریک حاوی اکسیژن
نکته مهم در واکنشهای اکسیداسیون و احیا سرعت انجام واکنشها میباشد. طبق اصول سینتیکی باید سرعت انجام واکنش اکسیداسیون با سرعت انجام واکنش احیا برابر باشد. بنابراین با تحت کنترل قرار دادن هریک از این دو واکنش میتوان سرعت انجام واکنش دیگر و در نتیجه سرعت انجام واکنش خوردگی را تحت کنترل درآورد.
از طرف دیگر اگر در سیستم خوردگی به جای یک عامل احیا چندین عامل احیا وجود داشته باشد، به عنوان مثال در همان اسید کلریدریک اگر اکسیژن نیز وجود داشته باشد، آنگاه دو واکنش احیا هیدروژن و واکنش احیا آب همزمان انجام خواهند شد. به این ترتیب به دلیل افزایش در میزان مصرف کنندههای الکترون، باید بر میزان سرعت تولید الکترون نیز افزوده گردد و به این دلیل سرعت خوردگی فلز روی افزایش خواهد یافت.
علاوه بر فاکتورهای محیطی و محیط خورنده، بعضی فاکتورهای فلزی و متالورژیکی نیز در آغاز و نرخ پیشرفت واکنشهای خوردگی تاثیرگذار میباشند. به عنوان مثال مرزهای دانه، مرزهای دوقلویی، ناخالصیها و نابجائیها میتوانند به دلیل داشتن انرژی بالاتر نسبت به نقاط اطراف خود به صورت آند موضعی درآمده و سبب آغاز فرایند خوردگی گردند.
روشهای کنترل خوردگی
از اصلی ترین روشهای کنترل خوردگی میتوان به موارد زیر اشاره داشت:
- انتخاب صحیح آلیاژ
- بکارگیری پوششهای مقاوم
- بکارگیری بازدارنده های خوردگی (Inhibitor)
- حفاظت کاتدی و آندی (Cathodic & Anodic protection)
|